«La FDA non ha approvato il vaccino Pfizer»: le fake news del senatore Paragone
Il 24 agosto 2021 il senatore Gianluigi Paragone pubblica sul proprio blog un articolo dal titolo «Il vaccino Pfizer è stato approvato in via definitiva o è ancora in uso emergenziale?» successivamente condiviso nella sua pagina Facebook con il seguente commento: «La FDA non ha approvato il vaccino Pfizer in via definitiva: il documento ufficiale che lo proverebbe». In un video afferma che negli Stati Uniti avrebbero invece rinnovato l’autorizzazione in via emergenziale, sostenendo che Il Corriere della Sera (e altri quotidiani) avrebbero diffuso una fake news, ma non è così.
Per chi ha fretta
- Il vaccino Pfizer (Comirnaty) è stato approvato dalla FDA per gli individui in età compresa e superiore ai 16 anni.
- L’utilizzo in via emergenziale risulta ancora presente per gli individui dai 12 ai 15 anni compresi.
Analisi
Gianluigi Paragone, in un video pubblicato nella sua pagina Facebook, accusa il Corriere della Sera di aver diffuso una notizia falsa in merito all’annuncio da parte della FDA sul vaccino Pfizer.

L’immagine utilizzata per il post Facebook dal senatore Paragone risulta essere la stessa pubblicata nell’articolo de Il Corriere dal titolo «Pfizer, ok definitivo di Fda dai 16 anni in su. Il vaccino non è più emergenziale: cosa significa», articolo riportato attraverso uno screenshot nel suo blog. Il testo è chiaro fin dal titolo, infatti l’elemento chiave di tutta la vicenda riguarda innanzitutto l’età.

Lo stesso articolo del Corriere spiega: «Il vaccino Pfizer/BioNTech continuerà ad essere autorizzato in via emergenziale per i 12-15enni, ma i produttori stanno raccogliendo i dati per chiedere la piena approvazione anche in questa fascia di età».
Cosa dice il sito della FDA
Partiamo dalla fonte, linkata anche nel blog del senatore Paragone, ossia il comunicato della FDA nel sito ufficiale che riporta il seguente titolo: «FDA Approves First COVID-19 Vaccine». Non si parla di rinnovo, ma di approvazione del primo vaccino anti Covid19.
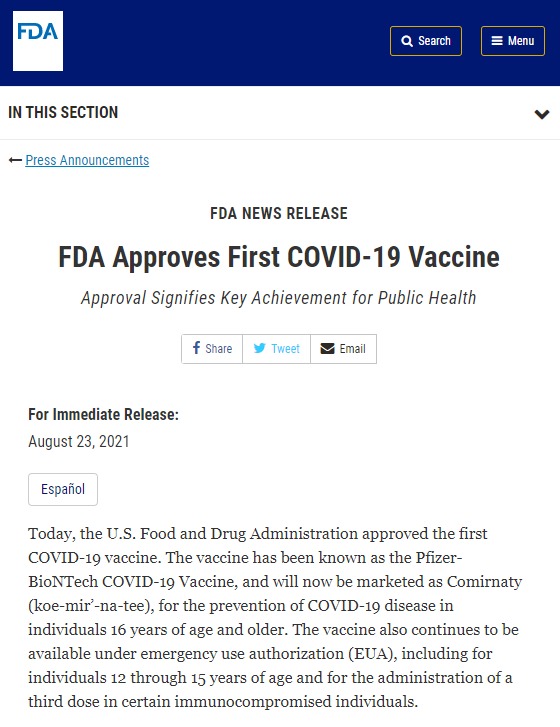
Nel primo paragrafo del comunicato si riporta quanto affermato anche dal Corriere, ossia che il vaccino Pfizer è stato definitivamente approvato per gli individui in età pari o superiore ai 16 anni, ma che continuerà ad essere utilizzato in via emergenziale per coloro che hanno più di 12 anni e fino ai 15. Allo stesso modo, la via emergenziale riguarderà la terza dose per gli immunodepressi:
Today, the U.S. Food and Drug Administration approved the first COVID-19 vaccine. The vaccine has been known as the Pfizer-BioNTech COVID-19 Vaccine, and will now be marketed as Comirnaty (koe-mir’-na-tee), for the prevention of COVID-19 disease in individuals 16 years of age and older. The vaccine also continues to be available under emergency use authorization (EUA), including for individuals 12 through 15 years of age and for the administration of a third dose in certain immunocompromised individuals.
Le stesse informazioni risultano pubblicate dall’account Twitter della FDA in due diversi tweet (qui e qui).
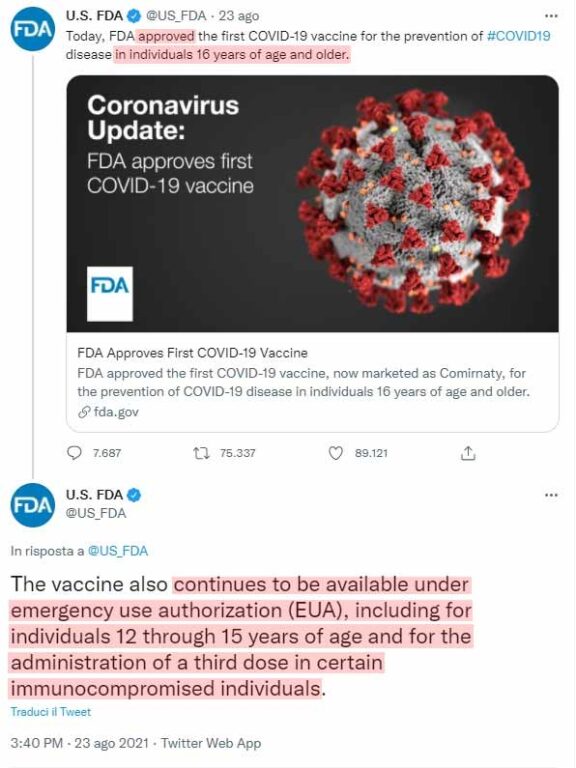
Nel caso, è possibile leggere anche la versione in lingua spagnola del comunicato:
Hoy, la Administración de Alimentos y Medicamentos de los EE. UU. (FDA,por sus siglas en inglés) aprobó la primera vacuna contra el COVID-19. La vacuna se conoce como la vacuna de Pfizer-BioNTech contra el COVID-19, y ahora se comercializará como Comirnaty (koe-mir’-na-tee), para la prevención de la enfermedad del COVID-19 en personas de 16 años o mayores. La vacuna también sigue estando disponible bajo la autorización de uso de emergencia (EUA, por sus siglas en inglés), que incluye a personas entre 12 a 15 años de edad y para la administración de una tercera dosis en ciertas personas inmunocomprometidas.
Il documento della FDA smentisce il comunicato della FDA?
Che la Food and Drug Administration stia mentendo e la prova è nel documento allegato nel blog del senatore Paragone? Per sostenere la sua tesi, invita i lettori a verificare di persona all’interno di un file PDF tradotto in italiano composto da 19 pagine. Al suo interno troviamo una cronologia degli eventi, per poi arrivare a pagina 2 (nel documento in inglese) dove leggiamo:
On August 23, 2021, FDA approved the biologics license application (BLA) submitted by BioNTech Manufacturing GmbH for COMIRNATY (COVID-19 Vaccine, mRNA) for active immunization to prevent COVID-19 caused by SARS-CoV-2 in individuals 16 years of age and older.
On August 23, 2021, having concluded that revising this EUA is appropriate to protect the public health or safety under section 564(g)(2) of the Act, FDA is reissuing the August 12, 2021 letter of authorization in its entirety with revisions incorporated to clarify that the EUA will remain in place for the Pfizer-BioNTech COVID-19 vaccine for the previously-authorized indication and uses, and to authorize use of COMIRNATY (COVID-19 Vaccine, mRNA) under this EUA for certain uses that are not included in the approved BLA.
Ecco la traduzione (pagina 3, errori compresi) riportata nel blog del Senatore:
Il 23 agosto 2021, la FDA ha approvato la domanda di licenza biologica (BLA) presentata da BioNTech Manufacturing GmbH per COMIRNATY (VACCINE COVID-19, mRNA) per l’immunizzazione attiva per prevenire il COVID-19 causato da SARS-CoV-2 in individui di 16 anni di età. età e oltre.
Il 23 agosto 2021, avendo concluso che la revisione di questa EUA è appropriata per proteggere la salute o la sicurezza pubblica ai sensi della sezione 564 (g) (2) della legge, la FDA ha ripubblicato la lettera di autorizzazione del 12 agosto 2021 nella sua interezza con revisioni incorporato per chiarire che l’EUA rimarrà in vigore per il vaccino Pfizer-BioNTech COVID-19 per l’indicazione e gli usi precedentemente autorizzati e per autorizzare l’uso di COMIRNATY (VACCINE COVID-19, mRNA) ai sensi di questo EUA per determinati usi che sono non incluso nel BLA approvato.
Il testo è chiaro. Il documento della FDA riporta che il vaccino è stato approvato per gli individui in età pari e superiore ai 16 anni, mentre l’uso emergenziale (EUA) rimarrà in vigore per determinati usi che non sono stati inclusi nel BLA approvato. Che cos’è il BLA? La «biologics license application», per farla semplice è l’autorizzazione al commercio del prodotto. Il documento prosegue spiegando, tornando indietro cronologicamente nella ricostruzione, le varie fasi per l’autorizzazione in via emergenziale della vaccinazione per gli individui di età pari e superiore ai 12 anni e fino ai 15 compresi, così come per determinate categorie di individui immunodepressi.
L’ultima pagina del documento
Ciò che viene riportato dai critici, sottolineato in grassetto nella traduzione fornita dal blog del senatore Paragone, è l’ultima parte del documento dove si parla di un’autorizzazione in via emergenziale:
Il presente EUA sarà efficace fino alla cessazione della dichiarazione dell’esistenza di circostanze che giustificano l’autorizzazione all’uso di emergenza di farmaci e prodotti biologici durante la pandemia di COVID-19 ai sensi della Sezione 564(b)(2) della Legge o fino alla revoca dell’EUA ai sensi della Sezione 564(g) della Legge.

La traduzione riportata nel blog del senatore riporta un altro paragrafo in grassetto sottolineato che però riguarda l’approvazione per gli individui dai 16 anni compresi in avanti, facendo un riferimento al prodotto precedentemente etichettato con l’autorizzazione in via emergenziale:
AA. COMIRNATY (VACCINE COVID-19, mRNA) è ora concesso in licenza per gli individui dai 16 anni in su. Rimane, tuttavia, una quantità significativa di vaccino Pfizer-BioNTech COVID-19 che è stato prodotto ed etichettato in conformità con questa autorizzazione all’uso di emergenza. Questa autorizzazione rimane quindi in vigore rispetto a quel prodotto per l’indicazione e gli usi precedentemente autorizzati (cioè, per l’uso per prevenire COVID-19 in individui di età pari o superiore a 12 anni con un regime a due dosi e per fornire una terza dose a individui di età pari o superiore a 12 anni che hanno subito un trapianto di organi solidi o a cui è stata diagnosticata una condizione che si ritiene abbia un livello equivalente di immunocompromissione).

Resta comunque la parte finale dove si sostiene che la presente autorizzazione in via emergenziale continuerà ad essere tale. Questo perché tale autorizzazione in via emergenziale riguarda solo i casi relativi agli individui di età compresa dai 12 ai 15 anni compresi.
La lista dei vaccini approvati
Nel sito della FDA troviamo un’area dedicata ai vaccini dove è presente la lista di quelli approvati e dunque non in uso in via emergenziale. Nell’elenco, dal 23 agosto 2021, troviamo anche quello di Pfizer (Comirnaty):
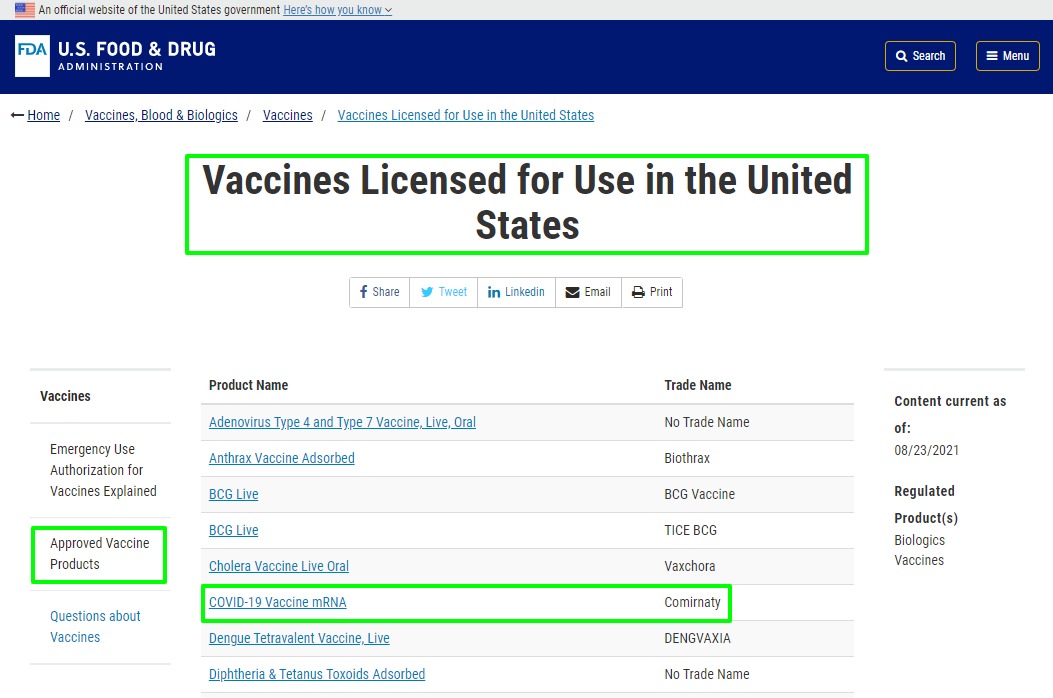
Il documento citato dal blog di Paragone, poi tradotto, si trova proprio nella scheda del vaccino linkata nella lista:
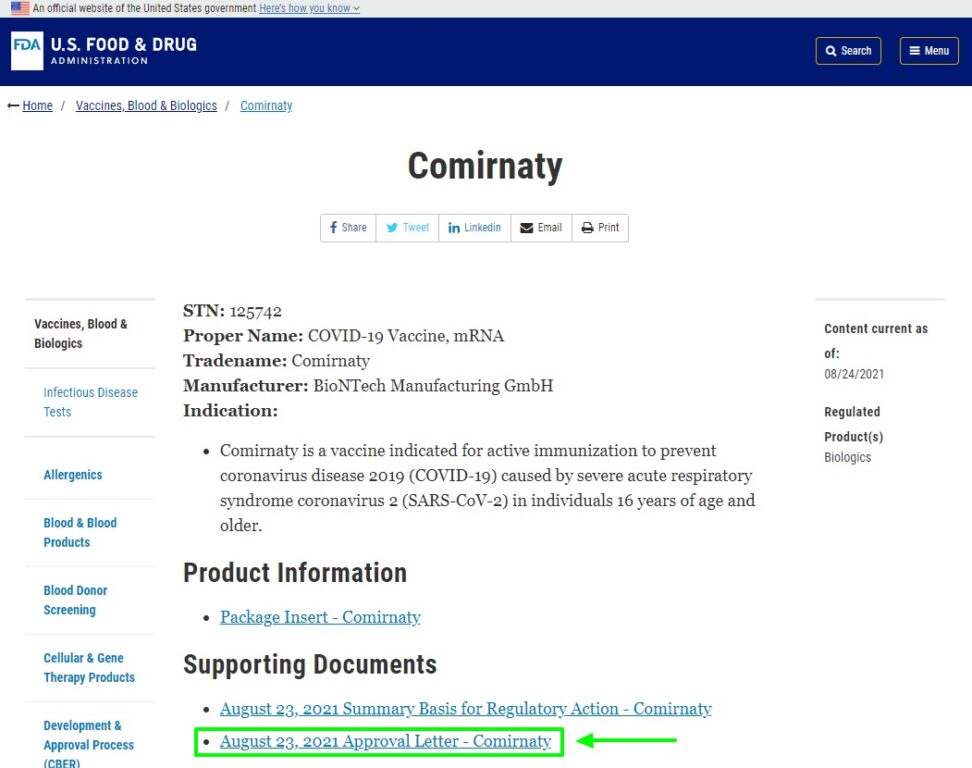
Nel documento precedente e linkato alla voce «August 23, 2021 Summary Basis for Regulatory Action – Comirnaty» leggiamo a pagina 3 che il vaccino è stato approvato (sigla BLA) per gli individui di età compresa e sopra i 16 anni:
BioNTech Manufacturing GmbH (in partnership with Pfizer Inc.) submitted a Biologics License Application (BLA) STN BL 125742 for licensure of COVID-19 Vaccine, mRNA. The proprietary name of the vaccine is COMIRNATY. COMIRNATY is a vaccine indicated for active immunization to prevent coronavirus disease 2019 (COVID-19) caused by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in individuals 16 years of age and older.

In questo salvataggio su Web Archive del 21 agosto 2021, dunque precedente all’approvazione del 23 agosto, il vaccino Pfizer non era presente nella lista di quelli approvati:

La risposta di Paragone
Il senatore Paragone, a seguito di questo articolo, sostiene che la stessa Pfizer affermi che il suo vaccino non sia stato approvato dall’FDA. A prova di ciò che dichiara, mostra in video il sito ufficiale della Pfizer dove legge quanto segue: «The Pfizer-BioNTech COVID-19 vaccine has not been approved or licensed by the U.S. Food and Drug Administration (FDA)».

Il senatore Paragone non mostra tutta la pagina della sezione Coronavirus del sito della Pfizer. Poco sotto ci sono gli aggiornamenti dove leggiamo: «Pfizer-BioNTech COVID-19 Vaccine COMIRNATY® Receives Full U.S. FDA Approval for Individuals 16 Years and Older».
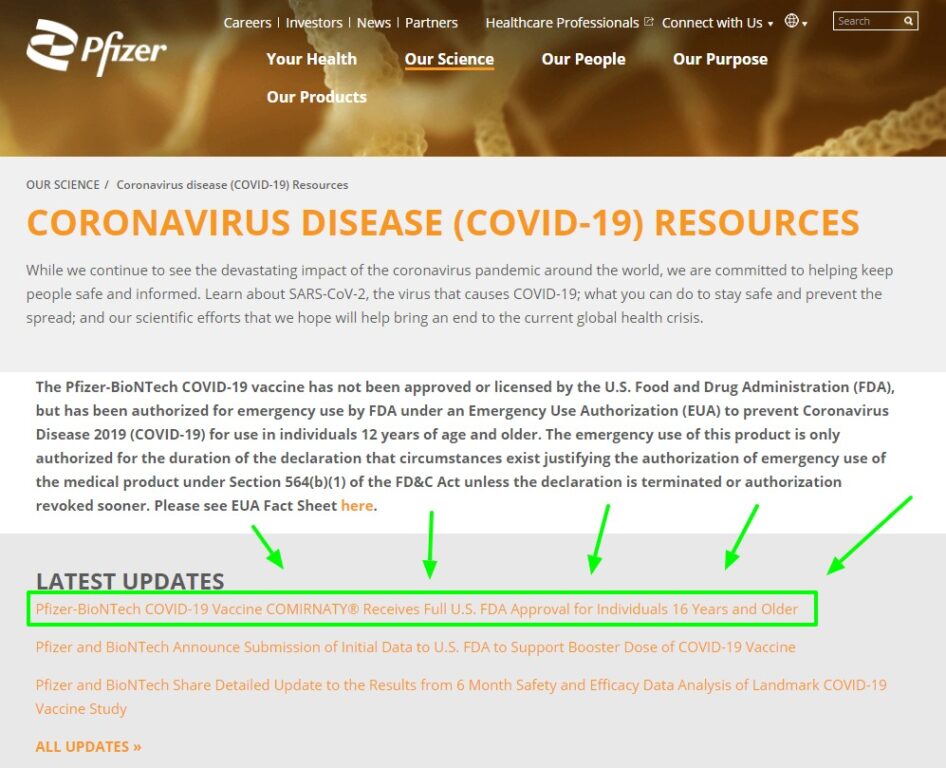
Ecco il comunicato di Pfizer sul proprio sito:

Il testo citato dal senatore Paragone era già presente prima del 23 agosto 2021, data dell’approvazione come riportato in questo articolo. Ecco un salvataggio su Web Archive del 13 agosto 2021:

Aggiornamento 28 agosto 2021
A seguito di una ulteriore risposta pubblicata dal senatore Paragone nel suo sito, un articolo dal titolo «No (insistiamo), non è vero! Ecco perché “l’approvazione” del vaccino Pfizer resta per “uso di emergenza”», abbiamo contattato direttamente la FDA per ottenere precisazioni a riguardo.
In risposta a Open, la FDA conferma che il vaccino Pfizer-BioNTech contro la Covid19, noto con il nome commerciale Comirnaty, è stato effettivamente approvato per gli individui dai 16 anni in avanti.
La FDA conferma la disponibilità del vaccino sotto l’autorizzazione emergenziale negli individui da 12 a 15 anni, così come per la somministrazione di una terza dose a determinati individui e immunodepressi.
La FDA precisa che l’autorizzazione in via emergenziale (EUA) continuerà a coprire la somministrazione del vaccino Pfizer negli individui dai 16 anni in avanti «fino a quando si possa produrre e distribuire sufficienti dosi del vaccino approvato».
Nell’area domande e risposte della FDA relative al vaccino Pfizer, oltre a informare riguardo l’approvazione per gli individui dai 16 anni in avanti, alla domanda «Resterà in vigore l’autorizzazione in uso emergenziale per il vaccino contro la Covid19 di Pfizer dopo l’approvazione?» si precisa che questa viene mantenuta «per ragioni logistiche».
Inoltre, bisogna precisare che l’autorizzazione all’uso emergenziale non viene avviato soltanto per i prodotti non approvati, ma anche per quelli approvati per altri scopi o malattie. Questo era successo con l’idrossiclorochina, un prodotto che era già in commercio ma non contro la Covid19, per il quale l’autorizzazione EUA è stata revocata nel 2020.
L’autorizzazione all’uso emergenziale del vaccino Pfizer per gli over 12 (dunque anche per gli over 16) viene mantenuta per coloro che riceveranno la terza dose del vaccino stesso. L’approvazione, infatti, riguarda gli over 16 con la somministrazione di due dosi, non tre. Ecco perché risulta presente un uso emergenziale di un prodotto approvato (il vaccino Pfizer) in condizioni diverse rispetto a quelle approvate (per due dosi, non per tre).
In merito alla precedente risposta del senatore Paragone, riportiamo che il sito ufficiale di Pfizer ha rimosso la dicitura mostrata nel suo video.

Riportiamo che nel sito dell’FDA, nella scheda «Comirnaty and Pfizer-BioNTech COVID-19 Vaccine», viene riportata la nota relativa all’approvazione del vaccino e la lettera di approvazione inviata all’azienda.
Conclusioni
Il vaccino Pfizer (Comirnaty) è stato approvato ed esce dall’utilizzo in via emergenziale per gli individui da età compresa a superiore ai 16 anni. Rimane l’utilizzo in via emergenziale per le età inferiori fino ai 12 anni compresi. La dichiarazione presente nella pagina Facebook del senatore Paragone «La FDA non ha approvato il vaccino Pfizer in via definitiva» risulta fuorviante, così come risultano scorrette le accuse rivolte al Corriere della Sera.
Le successive risposte da parte del senatore Paragone a questo articolo non forniscono alcuna prova a sostegno della sua tesi.
Open.online is working with the CoronaVirusFacts/DatosCoronaVirus Alliance, a coalition of more than 100 fact-checkers who are fighting misinformation related to the COVID-19 pandemic. Learn more about the alliance here (in English).
Leggi anche:
- Alessandro Meluzzi e il complotto dei vip che ricevono «falsi vaccini» anti Covid-19. Tutte le bufale del criminologo
- Vaccini inefficaci? I grafici pubblicati da Borghi per contestare Bassetti e Burioni non lo dimostrano
- Secondo Nature le vaccinazioni di massa generano nuove varianti resistenti ai vaccini? No! Lo studio dice altro
